1886 haben Charles Martin Hall und Paul Héroult dieses Verfahren etwa gleichzeitig unabhängig voneinander erfunden. Dieses Verfahren wird – mit einigen Verbesserungen – noch heute industriell angewandt.
Bei der Schmelzflusselektrolyse funktioniert Kryolith als Elektrolyt. Dieses weisse Mineral, eine Aluminiumverbindung mit Natrium und Fluor hat einen Schmelzpunkt bei ungefähr 1000ºC und kommt in der Natur nur in Grönland vor. Seit 1890 wird es allerdings überwiegend synthetisch hergestellt. Als Elektrolyt muss Kryolith in geschmolzenem Zustand vorliegen („Schmelzfluss“), so dass er bis zu 10% Aluminiumoxid zu lösen vermag. Beim Anlegen von 4 bis 5 Volt Spannung an die aus Kohlenstoff bestehenden Elektroden scheidet sich der Sauerstoff des Aluminiumoxids (d.h. Tonerde) an der Anode ab, wo er mit dem Kohlenstoff zu CO und CO2 verbrennt. Das Aluminium hingegen scheidet sich an der Kathode ab und wird somit zum Reinstaluminium.
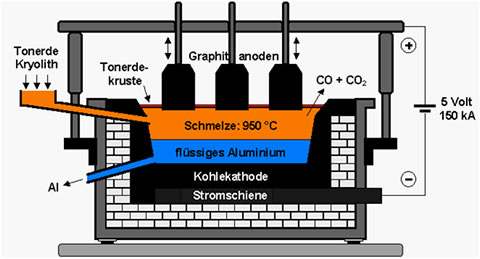
Aus 2t Tonrde lässt sich somit etwa 1t Aluminium gewinnen. Dieses auch „Hüttenaluminium“ genannte Reinaluminium wird oft noch in der Hütte zu Masseln, Walzbarren oder Pressbolzen gegossen, woraus dann die Halbzeuge angefertigt werden. Die ersten nach 1886 gebauten Zellen zur Schmelzflusselektrolyse waren Tiegel von einem Meter Durchmesser und hatten eine Anode. Um 1900 ging man zu rechteckigen Behältern mit 20m2 und mehr Fläche und bis zu einem Dutzend Anoden über. Heutige Elektrolysezellen sind im Prinzip immer noch gleich aufgebaut, wenn auch in Einzelheiten verbessert.













